為規(guī)范醫(yī)療器械注冊管理����,根據(jù)《醫(yī)療器械監(jiān)督管理條例》(國務(wù)院令第739號)和《醫(yī)療器械注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第47號),國家藥監(jiān)局組織制定了醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式(見附件)�,現(xiàn)予公布,自2022年1月1日起施行�。原國家食品藥品監(jiān)督管理總局發(fā)布的《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式的公告》(原國家食品藥品監(jiān)督管理總局公告2014年第43號)同時廢止。 特此公告�����。 附件:1.中華人民共和國醫(yī)療器械注冊證格式 2.中華人民共和國醫(yī)療器械變更注冊(備案)文件(格式) 3.國家藥品監(jiān)督管理局醫(yī)療器械臨床試驗審批意見單(格式).doc 4.醫(yī)療器械注冊申報資料和批準(zhǔn)證明文件格式要求.doc 5.醫(yī)療器械注冊申報資料要求及說明.doc 6.醫(yī)療器械延續(xù)注冊申報資料要求及說明.doc 7.醫(yī)療器械變更備案/變更注冊申報資料要求及說明.doc 8.醫(yī)療器械臨床試驗審批申報資料要求及說明.doc 9.醫(yī)療器械安全和性能基本原則清單.doc 例如:中華人民共和國醫(yī)療器械注冊證格式 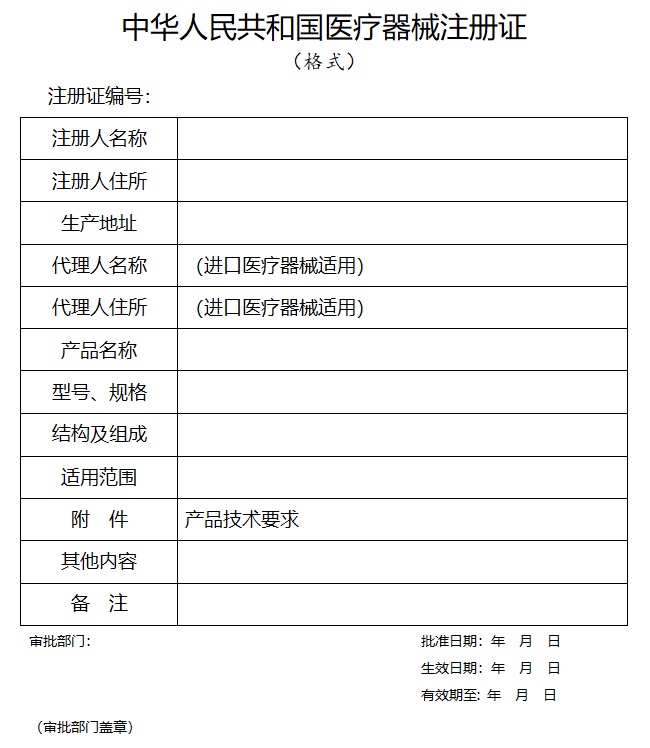
國家藥監(jiān)局 2021年9月29日
|